Proteomics Labolatory - 研究内容
研究テーマ
当研究室では、プロテオミクスをはじめ分子生物学、生化学、細胞生物学などのさまざまな手法を用いて、未知の細胞機能や疾患の発症機構の解明に取り組んでいます。これらのうち、疾患に関わる研究テーマ(疾患プロテオミクス)について紹介します。
○核膜病の発症機構の解明
○タンパク質やRNAの相分離を介した核内構造体および神経変性疾患で生じる凝集体の形成メカニズムの解明
○共同研究テーマ
○核膜病の発症機構の解明
細胞核には遺伝情報が刻まれたゲノムDNAが保管されていることから、核はすべての細胞機能に関わる情報の発信源としての重要な働きを担っています。核の内部は、外膜と内膜から成る核膜によって細胞質と隔てられています。核内膜は、Lamin Aを主要構成成分とする核ラミナによって裏打ちされており、核ラミナにはLEMドメインタンパク質(Emerin、LAP2およびMAN1)をはじめとする数多くのタンパク質が局在しています。また、LEMドメインタンパク質はBAFと結合し、これを介してクロマチンが核内膜に局在しています。この核ラミナと多様なタンパク質およびクロマチンのネットワークにより、核膜の維持、クロマチンの構成、遺伝子発現などの核機能が生み出されています(図1)。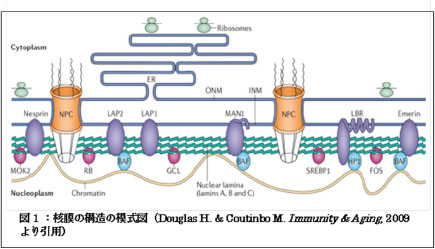
これまでに、いくつかの核ラミナ構成タンパク質および核ラミナ相互作用タンパク質をコードする遺伝子の変異に伴い発症する病気が報告されており、これらは「核膜病」と呼ばれています。私たちは、これらの変異に伴い核ラミナにおけるタンパク質のネットワークが撹乱されることで、本来の核機能に異常をきたすことで核膜病が発症するものと考えています。そこで、プロテオミクスの手法のひとつであるタンパク質間相互作用解析(リンケージ解析)を行うことで、変異に伴い具体的にどのような乱れが生じるのかをつきとめようと研究を進めています。このようなアプローチにより、核膜病の発症機構が解明され、新たな治療法の開発が進むことを期待しています(図2)。

現在私たちが取り組んでいる核膜病の研究について、以下に紹介します。
1. 早老症発症機構の解明
「老化」は、あらゆる生物にとって避けられない現象です。これまでに多くの研究者が「細胞老化」および「個体老化」の機構について精力的に研究してきた結果、多くの重要な知見が得られてきました。しかしながら、未解決の問題も多く残されているのも事実です。私たちは、核膜病である2つの早老症の発症機構の解明を目指した研究を進めています。
・Hutchinson-Gilford Progeria Syndrome発症機構の解明
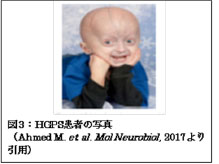
Hutchinson-Gilford Progeria Syndrome(HPGS)は、細胞核の裏打ち構造を形成する核ラミナの主要成分であるLamin A遺伝子の変異に伴い発症することが明らかにされています。その発症頻度は400万人に一人であり、極めて稀な疾患といえます。Lamin Aは、核の形態維持にとどまらず、クロマチンの配置や形成、DNA複製および遺伝子発現の制御などの重要な核機能全般に関わっています。LMNA変異を有する胎児はほぼ正常に発生し生まれますが、生後1年で脱毛、肘や膝の伸長不全などの著しい老化の兆候を示し、早発の冠動脈疾患が頻発し、その結果、ほとんどのHGPS患者は心筋梗塞で死亡します。HGPS患者の平均寿命は約13歳と非常に短いものです(図3)。これまでに、LMNA遺伝子の変異により異常Lamin A(progerin)が産生され、その結果、核膜に異形(核膜のしわなど)を生ずることが明らかにされています(図4)。
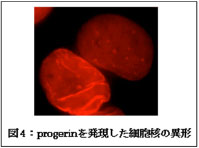
progerinの産生によりLamin Aの担う多様な核機能に異常が生じた結果、細胞レベルで老化過程が急速に進行し、HGPSが発症するものと考えられています。しかしながら、Lamin Aと多様な核内タンパク質との相互作用の観点からLamin Aの機能の解明を目指す研究は未着手であり、HGPS発症の原因解明の手がかりとなる知見はほとんど得られていませんでした。そこで、私たちは、安定同位体標識法とLC-MS/MS解析を組み合わせた定量的差異解析により、Lamin Aおよびprogerinそれぞれの相互作用タンパク質の比較を行いました。その結果、変異に伴ってLamin Aとの相互作用が喪失もしくは低下する複数のタンパク質を見出しました。私たちは、これらのうちDNA損傷応答に関与するDNA dependent protein kinase catalytic subunit(DNA-PKcs)に注目して実験を進め、HGPS患者の主な死亡原因である心筋梗塞を誘発する動脈中膜の血管平滑筋の欠落が、progerin産生によるDNA損傷応答経路を介した血管平滑筋の増殖抑制に起因することを明らかにしました。今後、progerin産生により活性化するDNA損傷応答経路を抑制する薬剤を探索することで、新たなHGPSの治療法の開発が進むことが期待されます。
・Néster-Guillermo Progeria Syndrome発症機構の解明
Néster-Guillermo Progeria Syndrome(NGPS)の患者は、幼少期から成長障害、皮膚の乾燥・委縮、骨粗鬆症および骨融解などの症状を呈します。一方で、成人期の初期には、高トリグリセリド血症、糖尿病、心血管障害などの兆候は見られず、患者の老化は、最も重度の早老症であるHGPSに比べて緩やかに進行することから患者の平均寿命も長いため、NGPSは慢性早老症と定義されています。NGPSは、およそ100万人に一人の頻度で発症する稀少疾患です。
NGPSは、核ラミナに結合するLEMドメインタンパク質と相互作用することで核内膜に局在するBarrier-to-autointegration factor(BAF)の遺伝子であるBANF1の変異によって、12番目のAlaがThrに置換した変異型BAF(A12T)が発現した結果、発症することが知られています。BAFは、ホモ二量体を形成して配列非特異的に二本鎖DNAと結合することで、多様な核機能に関わっています。私たちが行ったBAFの相互作用パートナーの網羅的な解析の結果、BAFが3つの独立したDNA損傷応答経路である塩基除去修復、ヌクレオチド除去修復および非相同性末端結合に関わる多数のタンパク質と相互作用することが明らかになりました。また、紫外線照射によるDNA損傷の誘発後、BAFとこれらのDNA損傷応答タンパク質との相互作用が低下することを見出しました。このことから、BAFが平常時においてDNA損傷応答タンパク質の足場として働くことでこれらを係留し、DNA損傷時にこれらを放出することでDNA損傷修復に関与している可能性が示唆されました。細胞老化とDNA損傷修復が密接に関連していることは広く知られていることから、私たちは、BAFの変異に伴ってBAFのDNA損傷応答に関わる機能に異常をきたすことで、NGPSが発症するものと考えています。
また、私たちは共同研究者とともに、in silicoタンパク質立体構造解析によるNGPS発症の原因となる変異型タンパク質A12Tのタンパク質間ネットワークの撹乱の分子レベルでの解明を進めています。今後は、NGPSの治療薬の開発を目指し、撹乱の修正を誘起する候補化合物の分子設計を試みていく予定です。
2. Emery-Dreifuss muscular Dystrophy発症機構の解明
Emery-Dreifuss muscular Dystrophy(EDMD)は、筋ジストロフィーの中でも稀な病型に位置付けられており、その発症頻度は約10万人に一人と報告されています。EDMDはもともと、核ラミナと相互作用して核内膜に局在するLEMドメインタンパク質のひとつであるEmerinの遺伝子(EMD)の変異によって発症するX染色体連鎖型潜性遺伝の核膜病として報告されました。Emerinは、細胞骨格制御、細胞増殖、および核膜構築などの多様な核機能を担っていることが示されています。その後、Lamin Aおよびイオンチャネル結合タンパク質FHL1をコードする遺伝子が、EDMDの病因遺伝子として報告されています。EDMDは、幼少期に発症し、肘部、後頸部、アキレス腱などの拘縮と進行性の上腕下腿型の筋委縮や筋力低下、心伝導障害を伴う心筋症という三大症状を特徴とする進行性筋ジストロフィーです。これまでに、上記の3つの病因遺伝子が報告されていますが、その発症機構の解明は進んでいません。
私たちは、野生型EmerinとEDMDの発症原因として報告されている6種類の変異型Emerinについてそれぞれの相互作用タンパク質の網羅的な解析を進めています。現在までに、Emerinが細胞分裂期の進行に重要な役割を果たしている複数のタンパク質と相互作用をするという新しい知見を得ています。今後、筋分化の過程におけるEmerinの細胞分裂期の機能が果たす役割を明らかにすることで、EDMDの発症機構の解明につながる新たな知見を得たいと考えています。
研究内容一覧に戻る
○タンパク質やRNAの相分離を介した核内構造体および神経変性疾患で生じる凝集体の形成メカニズムの解明
最近の研究によって、細胞内のタンパク質が不均一な状態であることが明らかになってきています。細胞内構造体が膜で囲われていなくても、天然変性タンパク質(領域)とRNAによる多価相互作用よって誘導される液-液相分離により、区画された液滴領域が形成され、生体反応の場が形成されます。この液-液相分離は、膜を持たない細胞内構造体の制御機構だけではなく、ALSや認知症、アルツハイマー病などの神経変性疾患との関連も強く示唆されています。しかしながら、これらの構造体の形成機構や生理的意義などの詳細なメカニズムは分かっていません。そこで私たちは、プロテオミクス解析を利用してこれらの詳しいメカニズムを解明することを目指しています。研究内容一覧に戻る
○共同研究テーマ/共同研究先
○Néster-Guillermo Progeria Syndromeの治療薬の開発
立命館大学生命科学部生命情報学科 菊地武司教授
○Hutchinson Gilford Progeria Syndromeの発症機構の解明
新潟大学大学院医歯学総合研究科循環器内科学・先進老化制御学 南野徹教授
千葉大学大学院医学研究院細胞治療内科学 木下大輔博士
○ヒトリボソーム生合成過程の解明
東京農工大学農学部応用生物科学科 高橋信弘教授
○脳の発生過程におけるmammalian target of rapamycin(mTOR)の機能解析
東京大学大学院医学系研究科疾患生命工学センター動物資源学部問 饗場篤教授
○線虫の発生過程におけるプロテオームの変動解析
立命館大学生命科学部生命情報学科 伊藤將弘教授
○Ptotein kinase N(PKN)の新規基質の網羅的探索
神戸大学バイオシグナル研究センター 向井秀幸准教授
金沢医科大学病理学I 吉崎尚良講師
○核内RNA顆粒の新規構成因子の探索
大阪大学大学院生命機能研究科 廣瀬哲郎教授
○
東京工科大学 応用生物学部 分子生物学研究室 西良太郎准教授
○
神奈川県立保健福祉大学 ヘルスイノベーション研究科 下畑宣行准教授
○
立命館大学 生命科学部 生命工学科 松村浩由教授・吉澤拓也講師(現 中外製薬)
○
立命館大学 薬学部 創薬科学科 北原亮教授
○
九州大学 先端物質化学研究所 穴田貴久准教授
○
東北大学 学術科学フロンティア研究所 奥村正樹准教授・金村進吾助教
○
東京工業大学 科学技術創成研究院 細胞制御工学研究センター 丹羽達也助教
○
東京都立大学 理学研究科 田岡万悟准教授
○
東京工業大学 科学技術創成研究院 細胞制御工学研究センター 井手聖助教
○
東京女子医科大学 実験動物研究所 世良康如助教
研究内容一覧に戻る