研究内容
環境微粒子に対する炎症応答機構の解明
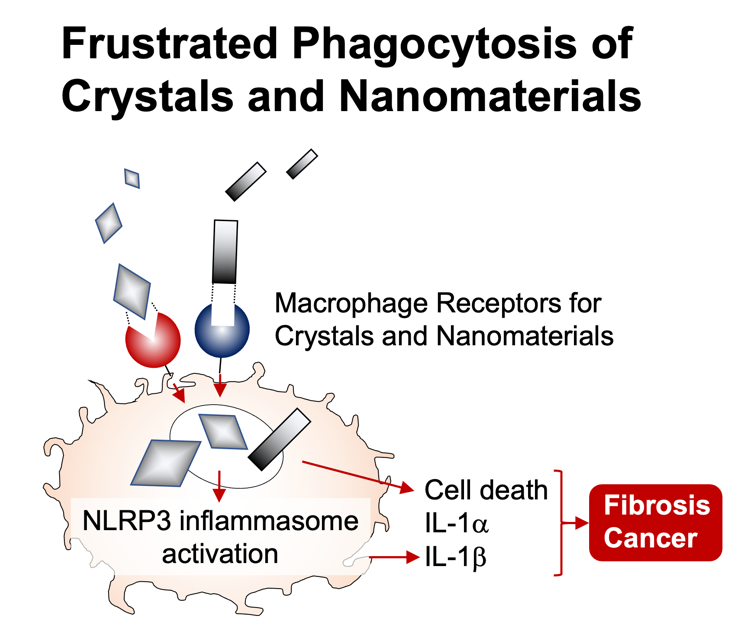
今日PM2.5、ディーゼル排ガスといった環境微粒子による健康被害が国際的に大きな社会問題となっています。また近年のナノテクノロジーの発展に伴い、多種多様なナノ材料が開発されていますが、これらの人体への影響もよく分かっていません。これら環境微粒子は生体内に入ると主に貪食細胞に認識され捕食されます。本来、貪食細胞は病原体を捕食することによって生体防御の砦として重要な役割を担っていますが、環境微粒子を捕食した場合は、ストレスを強く感じ、そのストレス応答から慢性炎症を惹起します。例えばシリカやアスベストによる珪肺や中皮腫はよく知られていますが、これらの発症にはマクロファージによる炎症応答が関与していると考えられます。
私たちはマクロファージがどのようにこれら環境微粒子を認識するのかを解明すべく研究を進めています。
- Yamaguchi et al. Nature Nanotechnol. 2023
- Kuroiwa et al. Sci. Total Environ. 2023
- Omori et al. Cell Rep. 2021
- Nakayama, Front. Immunol. 2018
- Tsugita et al., Part. Fibre Toxicol. 2017
- Tsugita et al., Cell Rep. 2017
Trogocytosisによる免疫応答制御
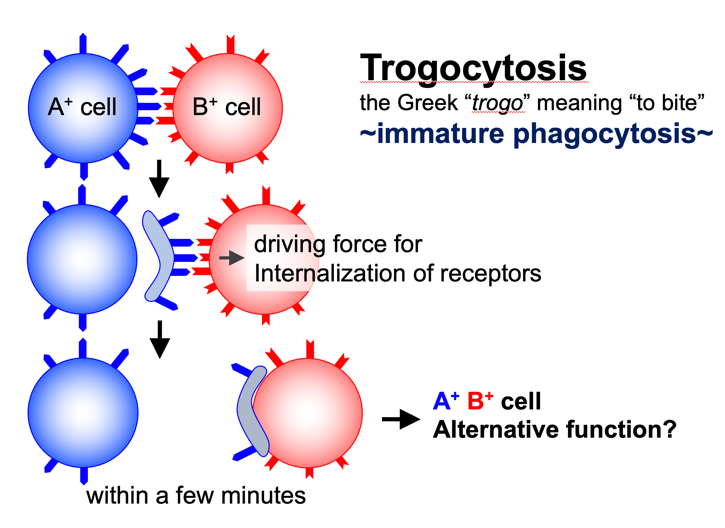
Trogocytosisとは、ラテン語で齧る(かじる)を意味するtrogoに由来する造語です。これは、2つの細胞が接触した際に一方の細胞膜断片がもう一方の細胞へダイナミックに細胞間移動する現象を示します。Phagocytosisが貪食細胞特有の機能であるのと対照的にTrogocytosisは全ての細胞が持つ機能だと考えられます。これまでに私たちは、主要組織適合複合体MHC分子が免疫細胞間で移動し、免疫応答を制御することを明らかにしてきました。Trogocytosisは多くの生物学的応答の修飾に関与していると考えられていますが、まだその分子メカニズムや生理機能など多くのことが分かっていません。
- Hori et al., iScience, 2024
- Nakayama, Cells, 2021
- Nakayama, Front. Immunol., 2015
- Nakamura et al., PNAS, 2013
- Nakayama et al., PNAS, 2011



