血管を備えた「ミニ網膜」を、完全3Dプリント製チップ上で再現 —加齢黄斑変性の病態研究と創薬評価に向けた新技術—
立命館大学グローバル・イノベーション研究機構(以下、R-GIRO)所属、薬学部の加堂アブドアルカーディル ロディ准教授(研究主導)と藤田卓也教授らは、ヒトiPS細胞由来の網膜オルガノイド※1と完全3Dプリントのマイクロ流体デバイスを組み合わせ、網膜—脈絡膜の境界構造を再現する、ヒト網膜モデルの構築に成功しました。さらに、網膜オルガノイドと血管内皮細胞を同一チップ内で共培養できることを示しました。本研究は、長崎大学の川上茂教授、順天堂大学の高島由季教授との共同研究として実施されました。
本件のポイント
研究成果の概要
ヒトiPS細胞由来の網膜オルガノイド(RPE〈網膜色素上皮〉領域を含む)と血管内皮細胞を、完全3Dプリントによる小型マイクロ流体チップ内で三次元共培養し、RPE近傍で血管様ネットワークが形成されることを明らかにしました。さらに、本共培養系がVEGFに対する応答性を有し、脂質ナノ粒子(LNP)の輸送挙動まで追跡できることを示し、「網膜オルガノイド・オン・チップ」技術を新たに確立しました。
研究の背景
網膜疾患は、重度かつ不可逆的な視力低下を引き起こす重大な疾患であり、特に滲出型加齢黄斑変性(AMD)では、脈絡膜由来血管の異常増殖(病的血管新生)が病態に深く関与します。しかし、網膜は構造が非常に複雑で、ヒトの病態をそのまま反映するモデルの構築が難しいことが課題でした。
新薬開発では動物モデルが広く使用されていますが、解剖学的・遺伝学的な種差により、ヒトの網膜病態や薬剤応答を十分に再現できない場合があります。そのため、ヒトの生体により近い形で再現できるOrgan-on-chip(臓器チップ)※4や、ヒトiPS細胞由来の網膜オルガノイドを活用したin vitro評価系への期待が高まっています。また、動物福祉の観点(3Rs:Replace代替・Reduce削減・Refine苦痛軽減)からも、動物実験への依存を補完・低減できるヒト関連性の高いモデルの整備が社会的に重要になっています。
一方で、網膜オルガノイドは有望であるものの、多くの場合血管(内皮細胞)を欠くため、AMDに直結する血管新生や、血管を介した輸送現象の評価が難しいというギャップが残っていました。
研究の内容
本研究では、幹細胞生物学と工学(3Dプリント/マイクロ流体)の技術を融合し、ヒトiPS細胞から網膜オルガノイドを分化誘導後、90日以上成熟培養することで、層状構造とRPE(網膜色素上皮)様の色素領域を備えた網膜様組織の構築に成功しました。免疫染色解析では、神経系マーカー(TUJ1)や視細胞マーカー(Recoverin)などを確認し、細胞多様性を担保しました(図1c)。さらに、柔軟な熱可塑性ポリウレタン(TPU)をFDM方式で造形し、透明PVC基板に接合した完全3Dプリント小型マイクロ流体デバイスを新たに開発しました。本デバイスでは、半透膜などの物理バリアを用いずに、オルガノイドとヒト血管内皮細胞(HUVEC)を同一のフィブリン–Matrigelマトリックス内に配置することで、より生理的な相互作用を狙いました(図1a,b)。
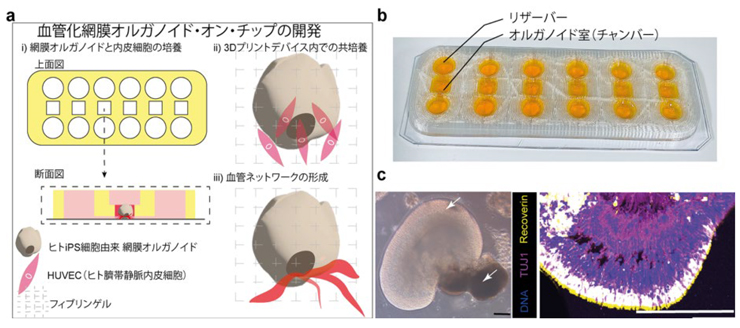
(a)血管化網膜オルガノイド・オン・チップの作製概略。(b)完全3Dプリントで作製した小型マイクロ流体チップの外観(リザーバーおよびオルガノイド室)。(c)網膜オルガノイドの代表画像(左)と免疫染色像(右)。網膜神経マーカー(TUJ1)および視細胞マーカー(Recoverin)。
この環境で共培養すると、内皮細胞が三次元的な血管様ネットワークを自己組織化し、RPE暗色領域の周囲に選択的に局在する一方で、オルガノイド内部へ明確に侵入せず界面に沿った構造として観察されました(図2a,b)。培養上清解析では共培養により内因性VEGF分泌が有意に増加し、外因性VEGF添加はオルガノイド成長に大きな影響を与えずにRPE近傍の血管ネットワークの拡張・局在をさらに促進したことから、本モデルがCNV関連のVEGF応答性リモデリング評価に有用であることが示されました。
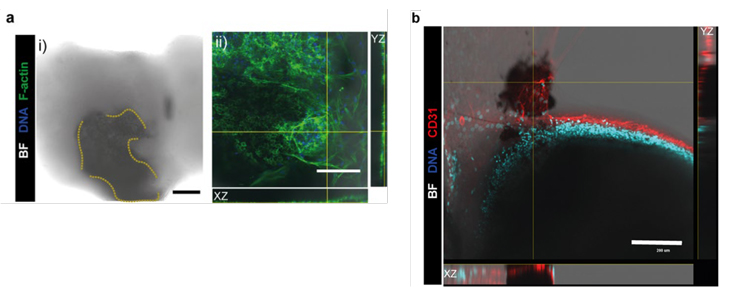
(a) 共培養後の代表像。オルガノイド周辺に形成された三次元的な血管様構造を観察した(緑:F-actin、青:DNA)。 (b) 断面(XZ/YZ)像。血管内皮マーカーCD31(赤)(青:DNA)。
さらに、蛍光デキストランに加えてローダミン標識LNPを灌流チャネルから導入しタイムラプスで解析したところ、LNPは均一に拡散せず血管化領域に沿ってオルガノイド界面へ時間依存的に集積し、血管構造が局在・保持に関与することが示されました(図3)。
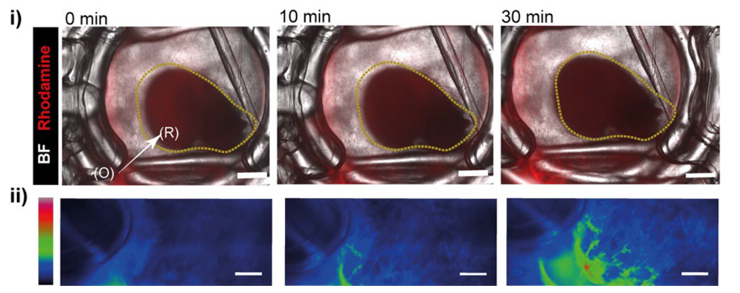
(i) 蛍光標識粒子(ローダミン標識)を用いた輸送評価の時間変化(0、10、30分)。(ii) 強度マップ表示。時間経過に伴う粒子シグナルの分布変化を可視化し、領域ごとの「届き方」の違いを評価できることを示す。
社会的な意義
本研究で確立した「網膜オルガノイド・オン・チップ」は、AMDなどで重要な網膜-血管相互作用や、VEGF依存的な血管リモデリングを、ヒト由来材料で評価できる実用的なin vitro基盤です。種差の影響を受けやすい動物モデルを補完し、よりヒトの病態に近い条件で候補薬の作用を検討できることで、創薬研究の予測性向上に貢献する可能性があります。また、本デバイスは完全3Dプリントで構成しているため、低コストかつ迅速に試作・改良が可能であり、多施設での再現・応用を促進し、研究現場での導入障壁を下げます。
さらに、脂質ナノ粒子(LNP)の輸送挙動まで評価できる「網膜オルガノイド・オン・チップ」を確立しました。今後、mRNA医薬の送達に用いられるLNPや、AMD治療で用いられる抗体医薬についても、本プラットフォーム上で作用や届き方を検証できる可能性があります。
加堂アブドアルカーディル ロディ准教授のコメント
AMDのように「血管の異常」が鍵となる網膜疾患を理解し、新しい治療法につなげるには、ヒトに近いモデルが不可欠です。本研究のチップは、iPS由来のミニ網膜と血管を同じ環境で共培養し、VEGF応答や薬の「届き方」まで評価できることを、今回初めて示しました。3Dプリントで作れる実用的なプラットフォームとして、基礎研究から創薬評価まで幅広い応用を目指します。
論文情報
- 論文名:Development of a 3D-printed microfluidic chip for retinal organoid–endothelial co-culture
- 著者:Rodi Kado Abdalkader*, Shigeru Kawakami, Yuuki Takashima, Takuya Fujita
- 発表雑誌:Lab on a Chip
- 掲載日:2026年2月2日(月)00:56(日本時間)
- DOI:10.1039/d5lc00939a
- URL:https://doi.org/10.1039/D5LC00939A
用語説明
- ※1 網膜オルガノイドヒトiPS細胞などから作製する、網膜の特徴を一部再現した三次元組織モデル。視細胞やRPEなど複数の網膜細胞が自己組織化する。
- ※2 VEGF(血管内皮増殖因子)血管新生を促す代表的な因子。滲出型AMDなどではVEGFシグナルが病的血管新生に関与し、抗VEGF薬が治療に用いられる。
- ※3 LNP(脂質ナノ粒子)脂質でできたナノサイズの粒子。mRNA医薬などの送達担体として重要で、本研究では蛍光標識リポソームをLNPモデルとして輸送評価に使用。
- ※4 Organ-on-chip(臓器チップ)微小流体デバイス上で細胞・組織を三次元配置し、流れなど生体条件を再現して機能や相互作用を評価する技術。




