2006年、山中伸弥教授(現・京都大学iPS細胞研究所所長)らの研究グループがマウス由来の体細胞に4つの遺伝子を導入することでこれをリプログラミング(初期化)し、iPS細胞の樹立に成功した。これは再生医療の展望が大きく開かれた歴史的な転換点だった。
通常細胞分化は不可逆であり、一度決まった臓器や組織に分化した体細胞は、例えばいったん心筋細胞に分化したならば、その後肝臓や神経など他の種類の細胞になることはない。それに対してリプログラミングとは、すでに分化した細胞からこの固定化された標識を消去して未分化の状態に戻し、体を構成するあらゆる種類の細胞に分化することができる多能性を持った幹細胞を作り出す現象を指す。リプログラミング技術によって、ヒトの皮膚などの体細胞からiPS細胞を作り、目的の臓器や組織に分化誘導して病気やけがで損なわれた部位に移植するといった再生医療が現実味を帯びるようになった。その他ヒト由来のiPS細胞を使って薬の候補化合物をスクリーニングするといった創薬への応用も期待されている。先ごろ大阪大学でiPS細胞から作った心筋細胞を用いて心不全などの心臓病の治療に役立てる臨床研究が始まったところだ。
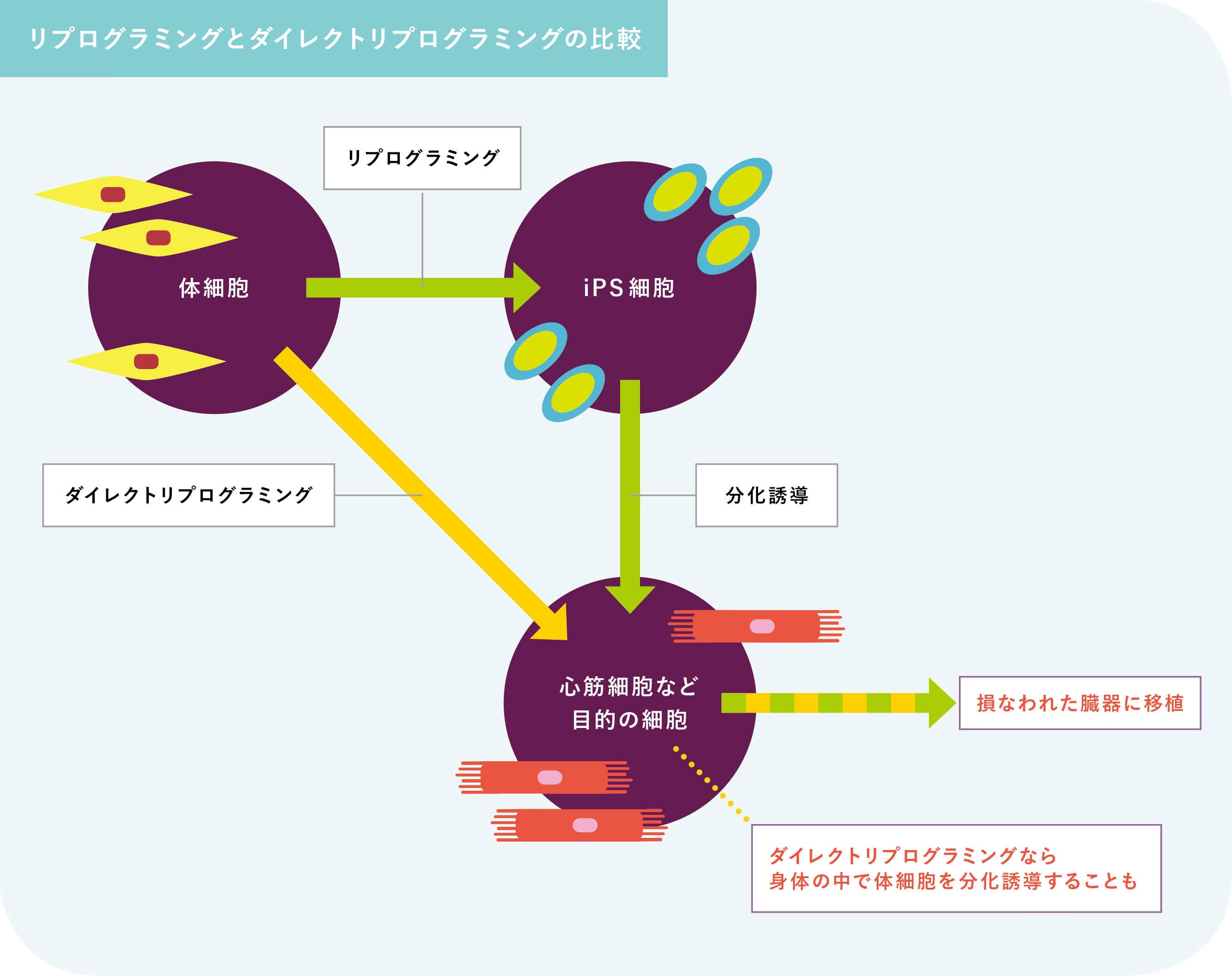
「とはいえリプログラミングを再生医療に応用するには依然として高い障壁があります」。中尾周はリプログラミング技術の現状をこう説明する。一つには体細胞を初期化してiPS細胞に戻してから分化誘導し、目的の細胞を樹立するまで長時間を要すること。加えて培養した心筋細胞のほとんどは筋線維の配列が不揃いで収縮力が弱く、つまり細胞の成熟度が低い。実際の心筋細胞と同じように拍動するまで成熟するのは数パーセントにも満たないのが現状だという。そして「実用可能なレベルにまでリプログラミングの性能を高める研究が進む一方で、もう一つ注目されている手法があります。それが『ダイレクトリプログラミング』です」と続ける。
ダイレクトリプログラミングとは体細胞に特定の因子を導入し、文字通りダイレクトに目的の細胞に性質を転換するというものだ。iPS細胞を作るプロセスが省略される分、時間もコストも削減できる上に誘導した細胞の成熟度も高い。加えてヒトの細胞を抽出して実験室で作製するiPS細胞と違い、例えば心筋に直接導入因子を注入し、身体の中で心筋細胞を誘導することも可能になるかもしれない。問題は、ダイレクトリプログラミングを促す因子を見つけ出すことだ。
リプログラミング技術はとりわけ罹患率・死亡率が高い心臓病の治療に大きな可能性を開いた。心臓は自己再生能力が極めて低く、現在は重症心不全においては心臓移植以外に有効な治療手段がない。
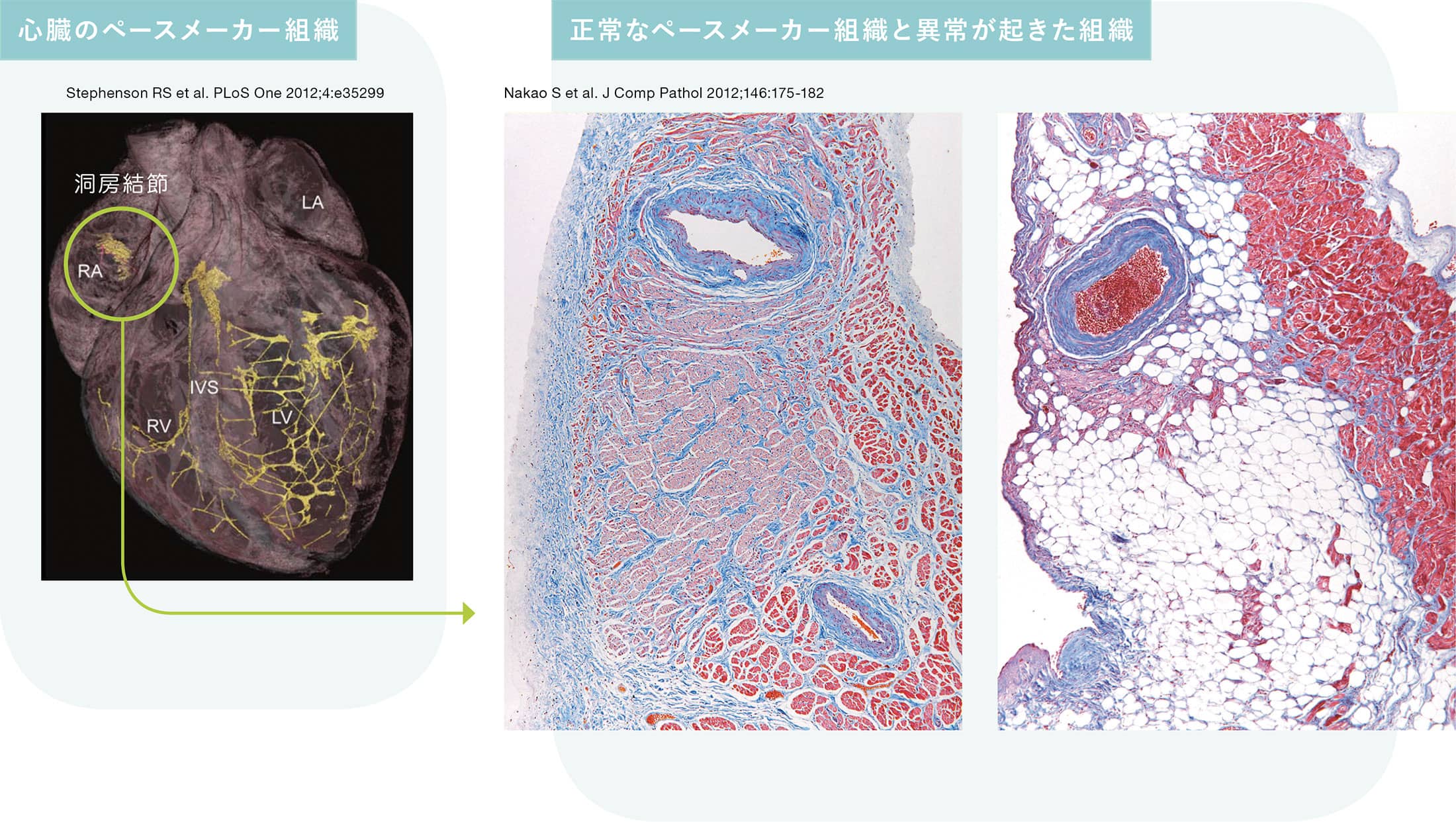
中尾は心臓の中でも特殊な細胞である「ペースメーカー細胞」に着目し、不整脈が発生するメカニズムの解明に取り組んできた。「ペースメーカー組織は刺激伝導系といわれ、心拍動の源となる電気信号を作り出し、それを心筋に伝える特殊な心筋群です。いわば心拍動の司令塔のような役割を果たしており、ペースメーカー組織に異常を来たすと心臓は正常なリズムで拍動しなくなってしまいます」と説明する。中尾によるとペースメーカー組織は部位によって異なる電気信号を発する性質があり、異常が起きる部位によって異なる種類の不整脈を起こすという。中尾はどのような因子がどこでどのように作用して不整脈を起こすのかを明らかにしようとしている。
その成果の一つとして、運動によって引きおこされる徐脈という不整脈の原因を調べた研究がある。徐脈とは心臓の拍動数が異常に減少した状態を指す。中尾の参画する研究グループは運動させて徐脈を誘発したマウスのペースメーカー組織内で変動する分子を解析し、その結果、miR-423-5pというマイクロRNAが徐脈の原因となっていることを突き止めた。「一般にマイクロRNAは遺伝子の発現を抑制する働きを持っています。通常はタンパク質が必要以上に合成されるのを抑えて正常なレベルに保つ働きを担っていますが、徐脈マウスではそのマイクロRNAがペースメーカー組織で異常に増加したことで、ペースメーカー組織の機能維持に重要な転写因子やイオンチャネルの量を減少させたと考えられます」。
さらに中尾らは、実際にマイクロRNAの発現を抑えると徐脈マウスの心拍数が正常に戻ったことを確かめ、「病気のときに変動するマイクロRNAや転写因子のような分子は細胞機能に影響を与えますが、ペースメーカー細胞のダイレクトリプログラミングを可能にする導入因子にもなるかもしれない」と推察する。こうした病気の原因となる因子を見つけ出す研究を通じて、ダイレクトリプログラミングに関わる導入候補因子を探索するのが次の課題だ。「いずれは因子を同定し、ペースメーカー細胞を作るリプログラミング技術を確立したい」と中尾。再生医療技術の進展に向けて新たな可能性が広がる。