細胞分裂装置のフィラメントと人工タンパク質により安定化された二重らせんの詳細な構造を世界で初めて明らかに~メカニズム解明や創薬に期待~
立命館大学生命科学部の松村浩由教授らの研究グループは、大阪大学大学院生命機能研究科の難波啓一 特任教授(常勤)、藤田純三 特任助教(常勤)、京都府立大学大学院生命環境科学研究科の田中俊一 准教授らと共同で、 細菌の細胞分裂装置の一部であるフィラメントおよび人工結合タンパク質により安定化されたフィラメントからなる二重らせんの詳細な構造をクライオ電子顕微鏡を用いて明らかにしました。 本研究成果は2023年7月11日(日本時間)、英国科学雑誌「Nature Communications」オンライン版に掲載されました。
本研究のポイント
- 細菌の細胞分裂装置の一部であるFtsZ フィラメントの溶液構造をクライオ電子顕微鏡を用いて世界で初めて高分解能で明らかにした。
- FtsZ に特異的に結合し、細胞分裂を阻害する小さな人工結合タンパク質(モノボディ)を取得し、X線結晶構造解析によりその結合様式を明らかにした。
- モノボディにより安定化されたFtsZ フィラメントの二重らせん構造をクライオ電子顕微鏡を用いて高分解能で明らかにした。
研究成果の概要
本研究では、細菌の細胞分裂装置の一部であるFtsZ フィラメントの溶液構造をクライオ電子顕微鏡を用いて世界で初めて高分解能で明らかにしました。 さらに、このFtsZ に特異的に結合する小さな人工結合タンパク質(モノボディ)を取得し、クライオ電子顕微鏡とX 線を用いた立体構造解析によりモノボディの結合様式を明らかにするとともに、 モノボディによって安定化された2 本のFtsZ フィラメントからなる二重らせん構造についても高分解能で構造決定に成功しました。 FtsZ は細菌の生存に必須であり、病原性細菌に対する抗菌薬のターゲットであるため、本研究により得られた知見は創薬への応用も期待されます。
研究の背景
黄色ブドウ球菌や肺炎桿菌等の細菌が引き起こす感染症、特に高齢者の院内感染は依然として世界的に大きな問題となっています。これらの感染症に対抗するための抗菌薬開発が進められてきましたが、従来使用されてきた抗菌薬に強い耐性を持つ薬剤耐性菌が出現したため、 新しい作用機序を持つ抗菌薬の開発が望まれています。その中でも、FtsZ というタンパク質は非常に多くの細菌に存在し、その生育に必須であることから創薬ターゲットとして注目されてきました。 細胞分裂において、FtsZ は細胞中心部でフィラメントを形成し、さらにフィラメントが束ねられてできたリングが収縮することで細胞分裂を進行させます(図1)。 FtsZ モノマーはGTP によりフィラメントの一方の端(+端)で重合し、フィラメント中でGTP を加水分解した後にもう一方の端(-端)で解離しますが、この重合や解離の際にFtsZ 自身の構造が変化すると考えられてきました。 この構造変化を捉えるために、これまで多数のFtsZ の分子構造がX線結晶構造解析(注1)により決定されてきましたが、この方法では結晶という分子が規則正しく高密度に並んだ状態での構造しか分からないため、 より生体内の状態に近いと言われる溶液状態での構造解析が望まれてきました。 2017年に初めてクライオ電子顕微鏡(注2)を用いた大腸菌由来FtsZ フィラメントの溶液構造が報告されましたが(文献1)、その分解能は7–8 Å 程度にとどまっていたため詳細な構造は不明でした。
研究の内容
FtsZ フィラメントは1 分子が単純につながった構造をしており、その細さと柔軟性により分解能が伸びていませんでした。
我々の研究グループは様々な細菌種のFtsZ を試した結果、アミノ酸配列が大腸菌とよく似ていますがわずかに異なる肺炎桿菌由来FtsZ が比較的安定なフィラメントを形成することを見出しました。
クライオ電子顕微鏡や解析のためのソフトウェアの急激な進化も相まって、我々は肺炎桿菌由来FtsZ フィラメントの溶液構造を世界で初めて3 Å という高分解能で決定し(図2)、
以前は見えていなかった詳細な構造を明らかにすることができました。特にFtsZ に結合している低分子の結合様式がこれまでのどの構造とも異なっており、この変化がFtsZ の機能に重要な役割を果たすのではないかと考えられます。
さらに、このFtsZ に特異的に結合する小さな人工結合タンパク質(モノボディ(注3))を取得することにも成功しました。
今回取得したモノボディは大腸菌由来FtsZ および肺炎桿菌由来FtsZ の両方に結合することができ、大腸菌の細胞分裂を阻害することも分かりました。
このモノボディと肺炎桿菌由来FtsZ を混合して結晶化し、X 線結晶構造解析を行うことでモノボディがFtsZ のどの部分に結合するのかも明らかになりました。
さらに我々は、電子顕微鏡での観察から肺炎桿菌由来FtsZ はモノボディ結合時に太くて安定なチューブ状構造を形成することを見出しました。
クライオ電子顕微鏡とEG-gridTM(注4)という特殊なグリッドを用いた構造解析により、このチューブ状の構造を2.7 Å という高分解能で決定することにも成功し、2本のFtsZ フィラメントからなる二重らせん構造をとっていることを明らかにしました(図3)。
また、モノボディについては2 本のFtsZ フィラメントの隙間を埋めるように結合しており、全体の構造を安定化していることも分かりました。モノボディがない場合でもより不安定ではあるものの似た構造をとるという結果も得られており、二重らせん構造あるいはその一部が生体内でも存在する可能性が示されました。
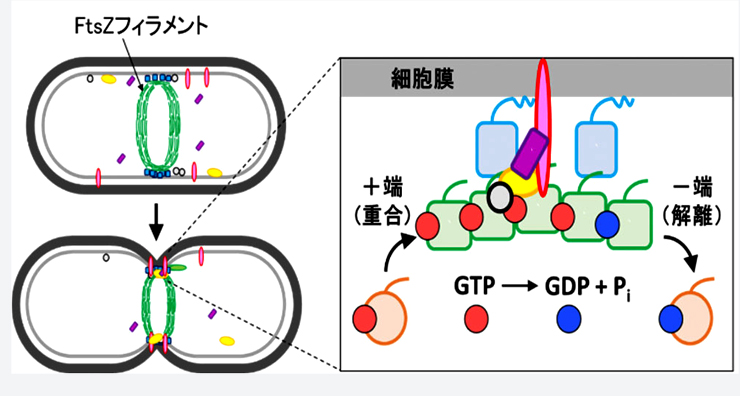
図1 細胞分裂におけるFtsZ の役割
FtsZ は細胞中心部でフィラメントを形成し、フィラメントが束ねられてできたリングが収縮することで細胞分裂が進行する(上図)。
FtsZ モノマーはGTP によりフィラメントの一方の端で重合し、フィラメント中でGTP を加水分解した後にもう一方の端で解離する(右図)。重合や解離の際にFtsZ自身の構造が変化すると考えられている。
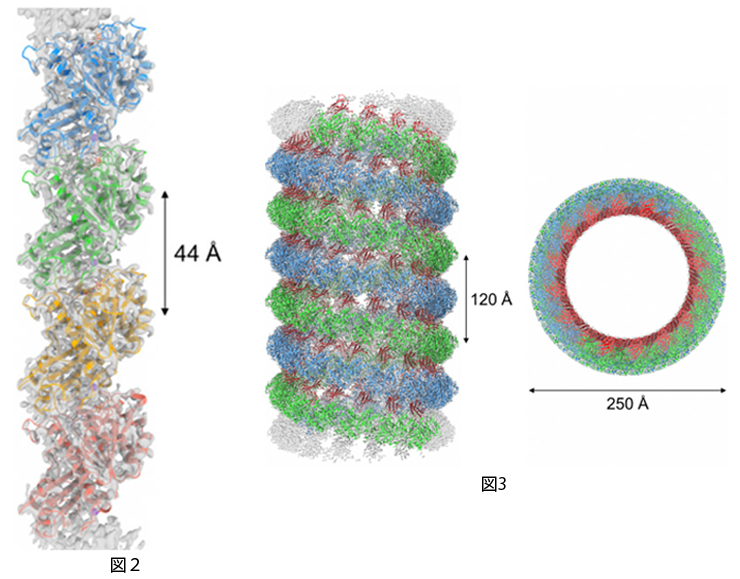
図2 FtsZ フィラメントの高分解能溶液構造
得られた電顕マップを半透明の灰色で、各FtsZ 分子をそれぞれ異なる色で示す。
図3 FtsZ とモノボディとの複合体からなる 二重らせん構造
得られた電顕マップを半透明の灰色で、2本の異なるFtsZ フィラメントをそれぞれ青色と緑色で、モノボディを赤色で示す。上図はらせん軸方向から見た図である。
波及効果・社会的な意義
本研究により得られた知見は細胞分裂という生命の根幹をなす現象の理解に繋がるだけでなく、創薬への応用も期待されます。 また、モノボディを利用することで構造を安定化し、より高分解能での構造解析を可能とする戦略は他のタンパク質にも適用でき、クライオ電子顕微鏡による構造解析の幅をより一層広げることになります。 今後はFtsZ フィラメントに結合する他のタンパク質やモノボディとの複合体の構造解析を行うことで、細胞分裂の根底にある詳細なメカニズムに迫っていきたいと考えています。
論文情報
- 論文名: Structures of a FtsZ single protofilament and a double-helical tube in complex with a monobody
- 著者: 藤田 純三(大阪大学生命機能研究科)、雨坂 心人(京都府立大学生命環境科学)、吉澤 拓也(立命館大学生命科学部)、日比野 滉太(立命館大学生命科学部)、上村 菜月(立命館大学生命科学部)、 黒田 奈津子(立命館大学生命科学部)、小西 隆元(立命館大学生命科学部)、加藤 夕貴(立命館大学生命科学部)、原 瑞穂(京都府立大学生命環境科学)、井上 豪(大阪大学薬学研究科)、難波 啓一(大阪大学生命機能研究科)、 田中 俊一*(京都府立大学生命環境科学)、松村 浩由*(立命館大学生命科学部)(*Corresponding authors)
- 発表雑誌:Nature Comminications
- 掲載日:2023年7月11日(火) 00:00(日本時間)
- DOI:10.1038/s41467-023-39807-5
- 掲載URL:https://www.nature.com/articles/s41467-023-39807-5
用語説明
(注1)X線結晶構造解析:目的の試料を結晶化し、その結晶にX線を照射することで得られる回折データを収集・解析することで試料の三次元構造を決定する手法。
(注2)クライオ電子顕微鏡:2017 年ノーベル化学賞受賞につながった、生体分子を極低温下で観察し、構造解析を行うために用いられる電子顕微鏡。 世界では日本電子社製とサーモフィッシャーサイエンティフィック社製(米国)がシェアを分けている。 日本電子社製のクライオ電子顕微鏡は、大阪大学大学院生命機能研究科の難波啓一特任教授(常勤)と東京医科歯科大学の藤吉好則特別栄誉教授らのグループとの共同研究によって長年開発が続けられてきた。 今回の成果にも日本電子社製のクライオ電子顕微鏡 CRYO ARMTM 300 および CRYO ARMTM 300 II が活用された。
(注3)モノボディ:ヒト由来フィブロネクチンⅢ型ドメイン(FN3)を改変した分子量 10 kDa ほどの小さな人工タンパク質。 構造表面に露出したアミノ酸配列を変えることにより、まるで抗体のように様々な分子に特異的に結合するモノボディを取得することができる。
(注4)EG-gridTM:大阪大学大学院生命機能研究科の難波啓一特任教授(常勤)、藤田純三特任助教(常勤)らと大阪大学大学院薬学研究科の井上豪教授、淺原時泰准教授らのグループが共同で開発した電子顕微鏡用グリッド。 グラフェン表面を特殊な化学反応で酸化、修飾することで観察対象タンパク質をグリッド上に高密度に吸着させ、クライオ電子顕微鏡像データ収集の大幅な効率化を可能にする。
参考文献
(文献1)Wagstaff et al., A Polymerization-Associated Structural Switch in FtsZ That Enables Treadmilling of Model Filaments, mBio 8, e00254–17 (2017).




