ヒトiPS細胞由来腎臓オルガノイドを用いた近位尿細管モデルを開発 ~薬物輸送体の機能解析と腎毒性評価のためのMicrophysiological systems (MPS)~
概要
京都大学大学院 工学研究科 横川隆司 教授、Cheng Ma 博士後期課程学生らの研究グループは、iPS細胞研究所荒岡利和特命助教、理化学研究所の髙里実チームリーダー、立命館大学 薬学部 根来亮介 助教らと共同で、ヒトiPS細胞由来の腎臓オルガノイドを使用して、近位尿細管オンチップモデル(Organoid-based Proximal Tubule-on-a-Chip, OPTC)を開発しました。このモデルは、薬物輸送体(トランスポーター)の機能評価や腎毒性試験において、従来のシステムを大きく上回る精度を実現しており、腎疾患研究や個別化医療の分野での応用が期待されます。 腎トランスポーターは、潜在的な薬物相互作用を予測する上で重要な役割を担っていますが、現在のin vitroモデルでは特に有機アニオントランスポーター(OAT1/3)、有機カチオントランスポーター2(OCT2)などを適切に発現していないことがほとんどです。そこで、本研究ではヒト腎組織を模倣したヒトiPS細胞由来の腎臓オルガノイドを作製し、オルガノイド由来の細胞を用いた近位尿細管オンチップモデル(OPTC)を開発しました。不死化細胞を用いた場合と比較して、OPTCはOAT1/3とOCT2をより高く発現しており、細胞極性もより強く示すことが分かりました。その結果、薬剤排泄と取り込みの評価、および腎毒性評価においても従来のモデルよりも高機能であり、さらに阻害剤を添加することによりトランスポーターの機能が低下することも実証できました。これらの結果は、OPTCが薬物輸送と腎毒性における腎トランスポーターの機能を評価できることを裏付けており、今後の疾患モデル作製を通して個別化モデルに道を開くものです。本研究成果は2024年8月18日に国際学術誌「iScience」のオンライン版に掲載されました。
【本件のポイント】
- 腎トランスポーターを評価する生体模倣システム(Microphysiological systems (MPS))として、ヒトiPS細胞由来腎臓オルガノイドの細胞を用いたOPTCを開発した。
- OAT1/3およびOCT2の発現と細胞内局在性が向上し、薬剤の排泄と取り込み能を評価することができた。
- OPTCが、薬剤相互作用や腎毒性を評価する基盤技術として、不死化細胞などを用いた従来法よりも優れていることを示した。
背景
腎臓は、体内の老廃物を排出し、薬物の代謝や排泄において重要な役割を果たす器官です。特に、近位尿細管は、血液をろ過して生成された原尿から必要な成分を再吸収し、不必要な物質を遠位尿細管や集合管に導くことで、生体の恒常性を維持しています。また、近位尿細管の膜に発現するSLCトランスポーターは、多種多様な物質の排泄において重要な役割を果たしており、生体内の恒常性と異物の効果的な排泄に欠かせません。
近年、これらの輸送体(トランスポーター)は、米国食品医薬品局(FDA)、欧州医薬品庁(EMA)、および我が国の医薬品医療機器総合機構(PMDA)などの規制機関によって、薬物相互作用研究において重要性が指摘されてきました。しかし、従来のin vitroモデルは、主に初代細胞や不死化細胞株を使用しており、これらの重要な輸送体の発現が不十分でした。また、遺伝子改変によって特定のトランスポーターの機能発現を達成することは可能ですが、通常この手法では単一のトランスポーターしか発現せず包括的な薬物相互作用の研究には適していません。このため、よりヒト近位尿細管の機能を模倣した定量的な評価システムが求められており、これを達成するためにマイクロ流体デバイス(注)を用いた生体模倣システム(Microphysiological systems (MPS))の開発が進められています。
そこで、本研究ではヒトiPS細胞から作製した腎臓オルガノイドの細胞をMPSに搭載することを着想しました。オルガノイドは、ヒト臓器の発生過程を模倣することで対象臓器の形態や機能を再現したものであり、様々な高機能細胞を含みます。腎臓オルガノイドから近位尿細管上皮細胞のみを分取してMPSに搭載することで近位尿細管モデル(OPTC)を作製して、その機能評価を実施しました(図1)。
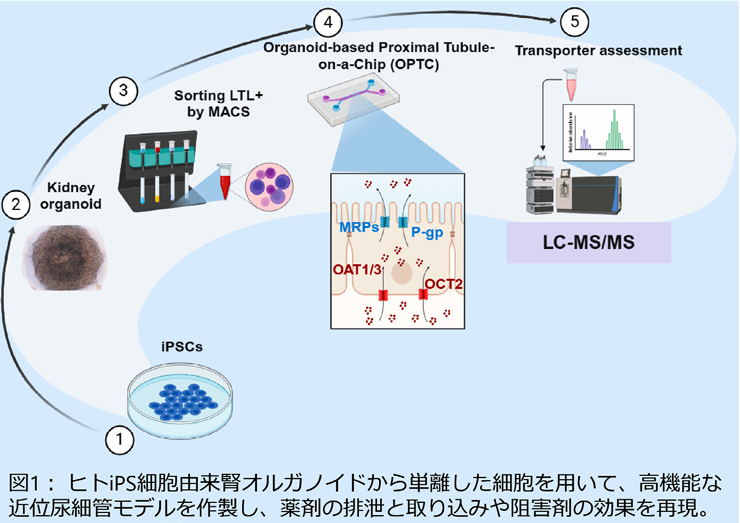 (提供元:横川隆司 京都大学工学研究科教授)
(提供元:横川隆司 京都大学工学研究科教授)
研究手法・成果
まず、2つのプロトコル(Takasato et al., Nat Protoc, 2016およびTsujimoto et al., Cell Rep, 2020)を用いてヒトiPS細胞由来の腎臓オルガノイドを作製しました。使用するiPS細胞やプロトコルにより各種トランスポーターの発現量は異なることが知られていますが、今回対象としたOAT1/3やOCT2についてはいずれのオルガノイドにおいても不死化細胞に比べ発現量が高いことを確認しました。そこで、磁気細胞分離法(MACS)を用いて近位尿細管上皮細胞に特徴的に発現するLTL陽性細胞をオルガノイドから単離し、MPSに利用することとしました。
本研究で用いたマイクロ流体デバイス(チップ)は、半導体微細加工技術に基づくソフトリソグラフィにより作製しました。フォトレジストSU-8をシリコンウエハ上にパターニングし、それを母型としてマイクロ流路(幅1 mm、高さ1 mm、長さ13.5 mm)を持つPDMSスラブを2つ作製しました。これらにより多孔質膜(ポアサイズ3.0 μm)を挟み、その上下に流路が配置される構造とし、上側に近位尿細管上皮組織を形成しました。流路の両端には、細胞の導入、培地交換、薬剤や阻害剤のサンプリングが容易に実施できるように直径2 mmのインレット・アウトレットを設置しています。
次に、準備したLTL陽性細胞をチップに導入してMPSを構成しました。以前、我々はオルガノイド由来細胞を用いて、トランスポーターであるSGLT-2やP-gpの輸送能を計測できることを示していますが、このときは不死化細胞と共培養することで上皮組織を形成していました(R. Banan Sadeghian et al., Commun Biol, 2023)。今回、新たにラミニン(iMatrix 511)をチップ内の多孔質膜上に塗布することで均一な上皮組織を作製することに成功しました。また、MPS構成後もOAT1/3やOCT2の発現が維持されていることが確認され、不死化細胞RPTECに比べてそれらの発現が強いことも確認できました(図2)。
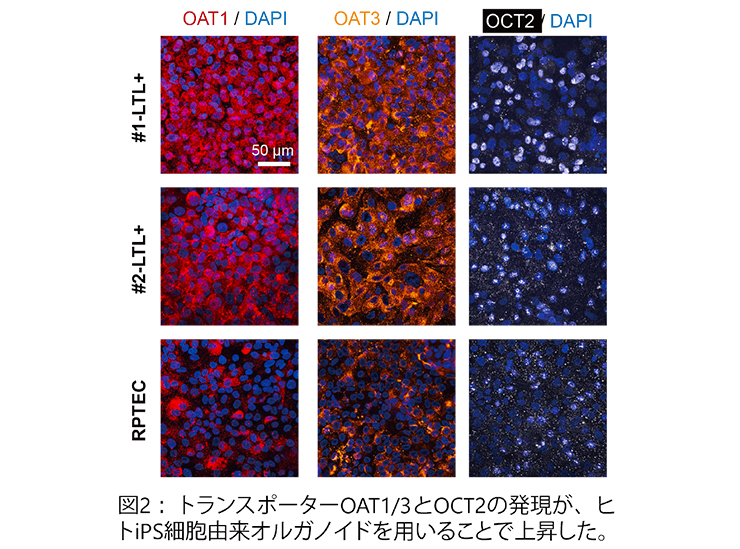 (提供元:横川隆司 京都大学工学研究科教授)
(提供元:横川隆司 京都大学工学研究科教授)
作製したMPSを用いて、トランスポーターによる基底膜側から頂端膜側への輸送と、基底膜側から細胞内への取り込みを評価しました。OAT1の基質であるAdefovirとPAH、OAT3の基質であるRosuvastatin、OCT2の基質であるMetforminについて、不死化細胞RPTECに比べオルガノイド由来細胞(#1-LTL+および#2-LTL+)を用いると基質輸送量も上昇することがわかりました(図3)。つまり、オルガノイド由来細胞を用いることでトランスポータータンパク質の発現だけでなく、それらの輸送能も向上していることがMPSにより実証されました。
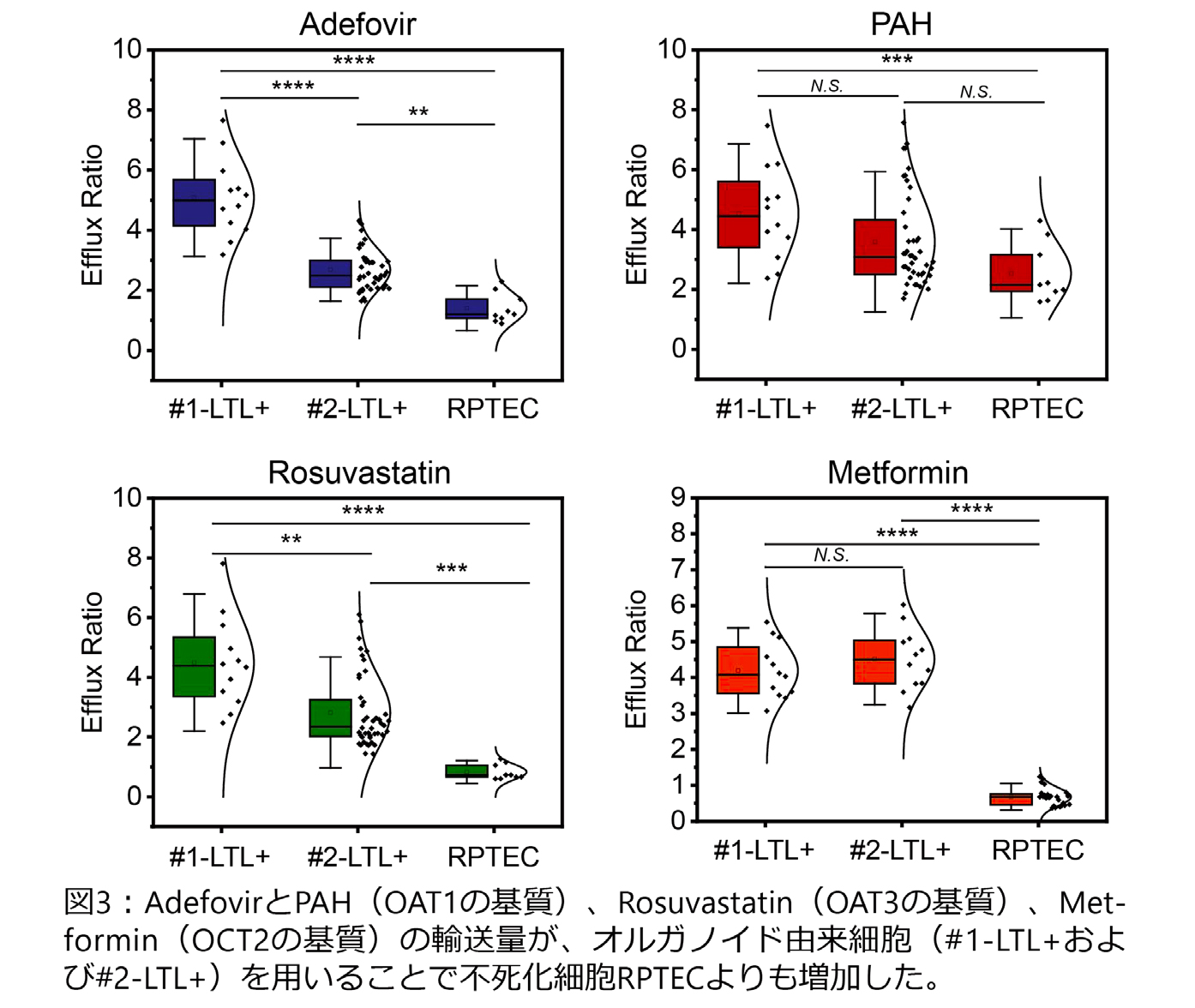 (提供元:横川隆司 京都大学工学研究科教授)
(提供元:横川隆司 京都大学工学研究科教授)
さらに、シスプラチン(OCT2によって輸送される腎毒素)やアリストロキア酸(OAT1/3によって基底側に輸送される腎毒素)による腎毒性を評価しました。いずれの腎毒素においても、オルガノイド由来細胞を用いた場合(#1-LTL+および#2-LTL+)、暴露後24時間で腎毒性が表れました。さらに、OCT2阻害薬であるCimetidineを導入すると(Cis & Cim)、シスプラチン毒性が低下することが実証できました(図4)。よって、開発したOPTCは、トランスポーターを介した薬剤の排泄と取り込みだけでなく、阻害剤の効果も適切に評価できる新たなMPSであることがわかりました。
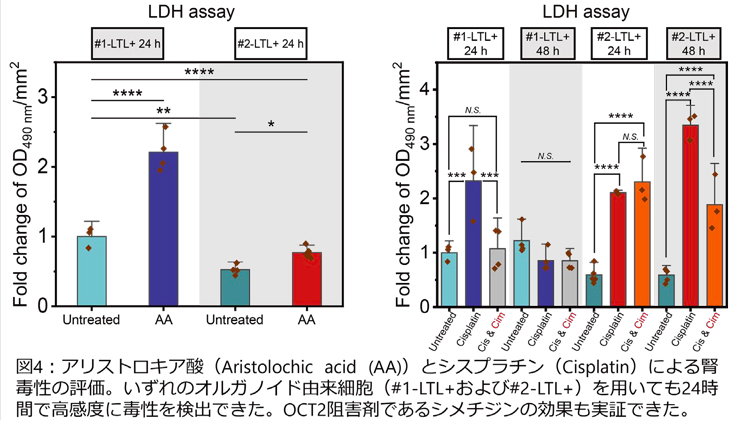 (提供元:横川隆司 京都大学工学研究科教授)
(提供元:横川隆司 京都大学工学研究科教授)
波及効果、今後の予定
複数のトランスポーターが薬物相互作用や腎毒性をもたらす近位尿細管上皮組織では、培養皿での培養ではトランスポーターの発現が低下してしまうなどの問題があり、それらを適切に評価するモデルが少ないのが現状です。今回開発したOPTCでは、生体内環境に近い条件下で腎トランスポーターの機能を正確に再現し、薬物相互作用を予測することができます。OAT1/3やOCT2に限らず、様々なトランスポーターの関わる基質輸送や阻害剤評価、腎毒性評価が可能です。ヒトiPS細胞を用いることで動物実験では見落とされていた阻害剤の効果や腎毒性を検出することが期待され、新薬のスクリーニングツールとして応用すれば、腎疾患メカニズムの解明、個別化医療や新たな治療法の開発に大きく貢献することが期待されます。今後は、疾患特異的なiPS細胞由来モデルの開発を進め、病態を再現したMPSモデルの実現を目指します。
研究プロジェクトについて
本研究は、日本医療研究開発機構(AMED)MPSプロジェクト(JP22be1004204, JP17be0304205)、文部科学省「マテリアル先端リサーチインフラ」事業(JPMX1222KT1172)の支援を受けました。
論文タイトルと著者
- タイトル: Efficient Proximal Tubule-on-Chip Model from hiPSC-Derived Kidney Organoids for Functional Analysis of Renal Transporters
- 著者: Cheng Ma (馬成)、 Ramin Banan Sadeghian、根来亮介、藤本和也、荒岡利和、石黒直樹、髙里実、横川隆司* (* 責任著者)
- 掲載雑誌: iScience
- 掲載日: 2024年8月18日
- DOI:https://doi.org/10.1016/j.isci.2024.110760
- 掲載URL: https://www.cell.com/iscience/fulltext/S2589-0042(24)01985-0
用語説明
注:マイクロ流体デバイス(チップ)は、半導体微細加工技術を用いて流路をガラスや樹脂基板上に作製したものである。臓器細胞を培養して生体内に近い環境を創成したチップは、Microphysiological systems (MPS)あるいは生体模倣システムと呼ばれる。今回の研究では、2つの異なる分化誘導プロトコルで作製した腎オルガノイド由来細胞を用いて腎近位尿細管上皮組織を再現した。




